Dott.
Antonello Paulesu
Termoablazione prostatica transrettale ecoguidata con ultrasuoni ad alta intensità focalizzati (PTTA/HIFU) nel trattamento del carcinoma prostatico
Scarica il documento completo
 Termoablazione.pdf (1,4Mb - Adobe Acrobat®) Termoablazione.pdf (1,4Mb - Adobe Acrobat®)
 Termoabalazione.zip (0,6Mb - Winzip®) Termoabalazione.zip (0,6Mb - Winzip®)
Premessa
La “Prostatic Transrectal Thermo-Ablation” con “High Intensity Focoused Ultrasound” (PTTA/HIFU) si propone quale trattamento mininvasivo del ca. prostatico.
Modalità di trattamento
Il principio su cui si basa è concettualmente analogo a quello del trattamento extracorporeo della calcolosi urinaria in cui dell'energia meccanica (onde d'urto) viene focalizzata in un punto corrispondente alla posizione del calcolo/bersaglio; in questo caso l'energia utilizzata è rappresenta da ultrasuoni ad alta intensità (HIFU) prodotti da una sorgente a 3 MHz collocata all'interno del retto del paziente (figura 1); gli ultrasuoni generati dal trasduttore mediante due ceramiche piezoelettriche vengono concentrati da una lente acustica in un punto focale posto a 40 mm dalla sorgente stessa. In corrispondenza del fuoco si genera una lesione elementare (figura 2) di forma elissoidale con una lunghezza che può variare fra i 19 e i 24 mm e un diametro massimo di 1,6 mm; all'interno dell'area compresa nella lesione si generano fenomeni di cavitazione con formazione di microbolle e la temperatura locale raggiunge gli 85 gradi centigradi determinando necrosi coagulativa del tessuto.
La determinazione del volume bersaglio avviene con l'ausilio di un software dedicato che tramite una sonda ecografica biplanare da 7,5 MHz abbinata al trasduttore di trattamento permette di suddividere la prostata in blocchi (in genere da un minimo di 4, due per lato a un massimo di 8, quattro per lato) che vengono disegnati lungo l'asse cranio-caudale e quello latero-laterale; ogni blocco viene quindi suddiviso lungo l'asse cranio caudale, utilizzando scansioni trasversali, in fette dello spessore di 1,5 mm, il cui numero è proporzionale alla profondità del blocco stesso. Durante la fase ecoguidata di panificazione dei blocchi di trattamento particolare attenzione viene posta all'identificazione dell'apice prostatico e dello sfintere immediatamente sottostante, la cui salvaguardia è essenziale per la preservazione della continenza.
  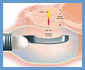  
clicca sulle immagini per ingrandirle
La fase successiva prevede il disegno, sempre assistito dal computer abbinato all'ecografo, su ogni fetta, del numero di lesioni che l'operatore ritiene necessarie a coprire tutta l'area che si è programmato di trattare; ognuna di queste lesioni può avere una profondità variabile da 19 a 24 mm a seconda dello spessore della fetta in esame mentre resta costate il diametro di 1,7 mm; non è quindi possibile trattare completamente prostate il cui diametro antero-posteriore sia superiore allo spessore massimo ottenibile di 24 mm; sempre in fase di programmazione il sistema rileva automaticamente per ogni fetta la distanza della parete anteriore del retto dal trasduttore e l'operatore fissa la distanza di sicurezza fra tale parete e la prostata (possono essere impostati valori variabili fra 3 e 6 mm) così da ridurre al minimo il rischio di fistole retto-uretrali conseguenti a lesioni termiche involontarie della parete rettale.
Terminata la fase di programmazione inizia la fase di trattamento vera e propria: il software ricrea passo per passo tutta la fase di programmazione (blocchi, fette, lesioni); ogni lesione prevede l'emissione di ultrasuoni con frequenza di 3 MHz e potenza di 50 Watt per 5 secondi seguita da una pausa di 5 secondi; possono quindi essere generate 6 lesioni al minuto e per ogni centimetro cubo di prostata sono necessarie 42 lesioni; il numero di lesioni varia grandemente in base al volume da trattare e mediamente va da 400 a 800, potendo però in alcuni casi arrivare a oltre 1000 (figura 3).
Ad ogni lesione il sistema riverifica in tempo reale la distanza fra trasduttore e parete rettale (200 misurazioni al secondo) e la macchina viene bloccata (e l'operatore allertato) qualora la discrepanza fra distanza attesa (programmata) e distanza misurata sia superiore a 1 mm.
Un'altro sistema di sicurezza è costituito da un rivelatore ottico che individua eventuali movimenti del paziente e arresta la macchina allertando l'operatore quando questi si verifichino
Per tutta la durata del trattamento un sistema di raffreddamento che si avvale della circolazione forzata di un liquido refrigerante (5-7 gradi centigradi) all'interno di un palloncino che ricopre il sistema sonda/trasduttore mantiene bassa la temperatura della parete rettale (range usuale intorno ai 15gradi).
La durata del trattamento è ovviamente direttamente proporzionale al numero di lesioni programmate e in genere varia fra i 90 e i 150 minuti.
Il paziente è sistemato in decubito laterale destro con le cosce flesse a 90° e in il trattamento viene abitualmente eseguito in anestesia locoregionale (spinale o peridurale) anche se in casi particolari è possibile ricorrere all'anestesia generale con intubazione oro-tracheale con escursioni ridotte del respiratore meccanico (onde evitare indesiderati movimenti prostatici). Controindicazione assoluta al trattamento è la presenza di una stenosi anale e di anchilosi delle anche.
Al paziente viene applicata, prima del trattamento, una cistostomia sovrapubica che verrà mantenuta in seguito fino alla ripresa della minzione attiva e alla scomparsa di un eventuale residuo vescicale postminzionale (in genere in un periodo variabile fra una e tre settimane).
Qualora sia presente un’ostruzione cervico-uretrale è necessario eseguire immediatamente prima del trattamento una resezione transuretrale prostatica (TURP) allo scopo di prevenirne l’inevitabile peggioramento dopo il trattamento. La TURP consente inoltre di: ridurre il volume prostatico, in particolare il diametro antero-posteriore ghiandolare; rimuovere l’eventuale microlitiasi prostatica che potrebbe interferire con la diffusione degli ultrasuoni nel tessuto prostatico.
Indicazioni e risultati
La premessa fondamentale è che allo stato attuale delle conoscenze il trattamento HIFU non è e non deve essere proposto come alternativa alla prostatectomia radicale o alla radioterapia definitiva; fatta salva questa premessa è possibile identificare le categorie di pazienti che è possibile avviare a questo trattamento; in primo luogo, come già accennato più sopra, vengono ritenuti candidabili e potenzialmente curabili pazienti con età superiore ai 70 anni, con aspettativa di vita > a 5 anni, con tumore localizzato alla prostata (T1-2), con pattern istologici non particolarmente aggressivi (Gleason score < 7 o, se = 7. formato da 3+4) e con PSA di esordio < 15 ng/ml. La limitazione di età al presente è a nostro avviso imperativa in quanto i controlli della casistica europea fin qui disponibili non sono sufficientemente protratti nel tempo per poter affermare con sicurezza che l'attività dimostrata nel medio periodo sia durevole.
Se questa è la categoria principale di pazienti, altri potenziali candidati sono quei soggetti che non possano per comorbilità limitanti essere sottoposti a trattamento chirurgico o radioterapico e coloro i quali presentino una recidiva locale prostatica da fallimento della radioterapia, istologicamente documentata; più raramente l’HIFU potrebbe essere proposto quando ci si trovi in presenza di una recidiva locale dopo chirurgia radicale qualora la lesione recidiva sia chiaramente visibile e mirabile ecografcamente.
Gli studi fin qui condotti a livello europeo, in particolare a Monaco di Baviera, a Lione e a Parigi hanno dato risultati molto soddisfacenti sia in termini di risposte del PSA che di negativizzazione delle biopsie. Lo studio multicentrico europeo è stato condotto, in sei centri, su 522 pazienti; in 328 l’HIFU è stato usato come terapia di prima scelta per neoplasia localizzata T1/T2 e in 224 come terapia di salvataggio per controllo locale (fallimento della radioterapia in 35 pazienti, recidiva locale dopo prostatectomia radicale in 8 pazienti, fallimento della terapia ormnonoablativa in 181 pazienti); nel primo gruppo è stata registrata una normalizzazione stabile del PSA nell’81% dei casi e una negativizzazione delle biopsie nell’82%; nel secondo gruppo il PSA si è normalizzato nel 76% dei casi e le biopsie sono risultate negative nel 79%.
Dati ancora più recenti sono stati presentati a Singapore al congresso Mondiale della Società Internazionale di Urologia (29 ottobre/2 novembre 2000) riguardanti 315 trattamenti in 250 pazienti con tumore localizzato alla prostata e con le caratteristiche cliniche elencate poco sopra (T1-2, N0 M0, PSA iniziale < 20 ng/ml) effettuati con il tradsuttore da 3 MHz (quello attualmente utilizzato) con il software 2.32, durata delle lesioni di 5 secondi, durata della pausa 5 secondi: i risultati cumulativi sono risultati più che soddisfacenti:e biopsie di controllo sono risultate persistentemente negative nell'85% dei casi con un follow-up medio di 2 anni mentre il PSA è ritornato a valori inferiori a 4 ng/ml nell'81,9 % dei trattati; un’analisi più particolare dei dati raccolti dai centri di Lione e di Parigi (Tabelle 1 e 2) mette in evidenza che il gruppo di Lione registra una caduta del PSA a valori < 4 nell’84% dei pazienti e < 1 nel 61% dei pazienti per un periodo medio di 36 settimane; per il gruppo di Monaco questi valori sono rispettivamente del 90% e del 65%; la quota di biopsie negative a Lione è risultata essere del 74% e a Monaco del 90%; guardando infine alla combinazione di PSA <4 e biopsia negativa, i dati sono 68% a Lione e 87% a Monaco, mentre la coppia PSA <1 e biopsie negative è del 48% a Lione e del 65% a Monaco (vedi tabella 1). La differenza in termini di attività a favore del gruppo di Monaco è verosimilmente legata a un protocollo di trattamento più aggressivo (media delle lesioni 733 a Monaco, 498 a Lione) che condiziona però anche una più alta incidenza di effetti collaterali e di morbilità, in particolare una ritenzione postoperatoria prolungata.
Esperienza personale
Nella nostra divisione, dove la metodica è in uso dal luglio 2000, abbiamo sottoposto fino ad oggi a PTTA/HIFU (Ablatherm®) 116pz con ca. prostatico localizzato così suddivisi: 34pz a basso rischio (T1-T2a e PSA<=10 e Gleason<7); 43pz a rischio intermedio (T2b o PSA 10-20 o Gleason= 7); 39pz ad alto rischio (T2c o PSA>20 o Gleason>8) (TNM’92). Dati basali dei pz (media?dev.stand): età 70,87?5.4anni; vol. prostatico 22.47?7.4ml (range: 7,6-50ml); IPSS 6.4?6.8; 45pz ormonotrattati; 49pz potenti. 88pz sottoposti a TURP in passato o prima della PTTA/HIFU; 5pz con pregressa adenomectomia transvescicale. Epicistostomia pretrattamento a tutti i pz. Durata media: 121min. Anestesia: periferica (81pz), generale (35pz). Controlli clinici e del PSA ogni 3 mesi più biopsia prostatica t.r. ecoguidata (6 prelievi) a 6 mesi. Risultati. F.U. medio: 17 mesi (range:2-27). Non complicanze intra e perioperatorie. Degenza media: 2gg dopo PTTA/HIFU; 4gg se associata TURP. Rimozione dell’epicistostomia dopo in media 19gg (?10,3gg). A 3 mesi (110pz) IPSS medio 2.6(?3.5); QoL score medio: 2?1. Nei 49pz potenti, potenza conservata in 27 casi (55%).
Risultati della biopsia a 6 mesi (104pz):
negativa 87,5% (91 pz) e positiva 12,5% (13 pz).
Suddividendo i pz in base alla classe di rischio la biopsia a 6 mesi è risultata:
basso rischio (28pz): negativa 96,4% (27pz) e positiva 3,6% (1pz);
rischio intermedio (39pz): negativa 92,3% (36pz) e positiva 7,7% (3pz);
alto rischio (37pz): negativa 75,6% (28pz) e positiva 24,4% (9pz).
PSA nei pz con biopsia negativa a 6 mesi (83pz): basale medio 7,99ng/ml (range: 26,9-0,01); a 6 mesi (81 pz) 0,5ng/ml (range: 4,71-0,01); a 12 mesi (53 pz) 0,64ng/ml (range: 3,92-0,01). PSA nei pz con biopsia a 6 mesi positiva (12pz): basale medio 7,74ng/ml (range: 21,5-1,82); a 6 mesi (12pz) 0,9 (range: 3,1-0,01).
Complicanze
Incontinenza da sforzo in 7pz sottoposti a TURP+PTTA/HIFU: lieve in 4pz, severa in 3pz. IVU in 3 pz. Epididimite in 3 pz. Stenosi uretra prostatica in 6 pz.
Conclusioni. La PTTA/HIFU consente risultati oncologici di rilievo ed è ben accetta ai pz grazie alla scarsa morbilità ed alla ridotta incidenza d'incontinenza ed impotenza.
Resta ovviamente da verificare la durata di questi risultati sui tempi lunghi (superiori a 5 anni) soprattutto in considerazione della storia naturale estremamente lenta di questa neoplasia. In ogni caso la morbilità operatoria e perioperatoria per questa categoria di pazienti è stata estremamente bassa; l'unico dato di rilievo essendo rappresentato dalla ritenzione urinaria nei giorni successivi al trattamento; rispetto alle prime serie di pazienti trattati l’incidenza di complicanze maggiori quali l’incontinenza urinaria e la formazione di fistole retto-uretrali è scesa a valori molto bassi (inferiore all’1%) grazie all’adozione di particolari accorgimenti tecnici derivati come è ovvio dall’esperienza accumulata nel tempo oltre che a un sempre maggior affinamento del software guida e dei sistemi di sicurezza.
In conclusione è possibile oggi affermare che la metodica HIFU è una possibilità terapeutica che offre una elevata attività nella cura del carcinoma prostatico localizzato in pazienti selezionati secondo i criteri esposti e in caso di fallimento della radioterapia, a fronte di una invasività e di una morbilità estremamente contenute. Non è al momento possibile considerarla una alternativa validata alla prostatectomia radicale e alla radioterapia esterna per il follow-up ancora troppo breve pur in presenza di risultati molto promettenti anche in tal senso.
Bibliografia
1. Kaver I., Ware JL, Koontz WW Jr: “The effect of hyperthermia on human prostatic carcinoma cells lines: evaluation in vitro” – J Urol, 1989; 141: 1025-1027
2. Gelet A., Chapelon JY, Bouvier R et al: “Treatment of prostatic cancer with transrectal focused ultrasound: early clinical experience” – Eur Urol, 1996; 29: 174-183
3. Gelet A, Chapelon JY, Guilloneau B, Vallancien G: “Local control of prostate cancer with HIFU: preliminary results of French multicenter study” – Eur Urol, 1998: 33 (Suppl 1): 211A, 53
4. Thuroff S, Chaussy C: “High Intensive Focused Ultrasound against prostate cancer. An additive tool before hormonal ablation?” – Eur Urol, 1998: 33 (suppl 1): 213A, 54
5. Gelet A, Chapelon JY, Bouvier R et al.: « Local control of prostate cancer by transrectal high intensity focused ultrasound therapy : preliminary resukts” – J Urol, 1999; 161: 156-162
6. Beerlage HP, van Leenders GJ, Oosterhof GO et al.: “High Intensity Focused Ultrasound followed after on to two weeks by radical retropubic prostatectomy: results of a prospective study” – Prostate, 1999; 39: 41-46
|



